研究方向
我目前的工作主要集中在活性粒子和运动诱导相分离。另外我对于系统生物学,非线性动力系统,以及用机器学习方法研究复杂系统均有兴趣。
活性粒子
活性粒子(Active particles)是一类可以驱动自身运动的粒子。这个概念可以用于描述诸如细菌、哺乳动物细胞、鸟群、鱼群甚至人群的宏观运动。活性粒子系统在自然界中非常普遍。
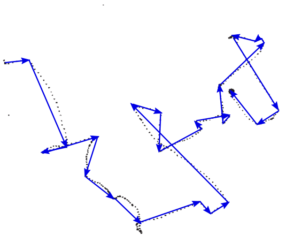
一个大肠杆菌细胞的运动轨迹,图片改自H. C. Berg and D. A. Brown, Nature, 1972
一群活性粒子构成的系统是一个典型的远离平衡态系统。每个粒子消耗能源(比如ATP)来产生驱动力,并且粒子与周围流体或基质的摩擦会不断耗散能量。通常因为溶剂分子的热涨落,或者粒子内马达的内禀动力学,粒子的取向无法长时间维持。因此粒子的能量与动量从微观上均已不守恒。
这就是为什么相较于静态的粒子,活性粒子可以表现出一系列复杂的行为。一群可以对齐的粒子可以形成团簇产生集体运动;有手性的活性粒子可以形成旋转的涡旋。即使是最简单的活性粒子,在力相互作用下也可以形成类似气液的相分离,甚至产生斑图。因为它们的远平衡态特质,活性粒子的世界非常的广阔!
代表论文
*具有相同贡献的作者
- Ruben Zakine*, Yongfeng Zhao*, Miloš Knežević, Adrian Daerr, Yariv Kafri, Julien Tailleur, Frédéric van Wijland, "Surface Tensions between Active Fluids and Solid Interfaces: bare vs dressed", Phys. Rev. Lett. 124, 248003 (2020). Preprint, Phys. Rev. Lett., Poster
- Eric Woillez, Yongfeng Zhao, Yariv Kafri, Vivien Lecomte, Julien Tailleur, “Activated escape of a self-propelled particle from a metastable state”, Phys. Rev. Lett. 122, 258001 (2019). Preprint, Phys. Rev. Lett.
- Thibault Bertrand, Yongfeng Zhao, Olivier Bénichou, Julien Tailleur, Raphaël Voituriez, “Optimized Diffusion of Run-and-Tumble Particles in Crowded Environments”, Phys. Rev. Lett. 120, 198103 (2018). Preprint, Phys. Rev. Lett.
运动诱导相分离
已有研究发现,如果某种相互作用可以降低活性粒子在高粒子密度区域的速度,我们可以看到类似气液的相分离,这通常被称为运动诱导的相分离(motility induced phase separation, MIPS)可以产生这种相分离的相互作用有群体感应和两体力相互作用。
群体感应是一种细胞感受周围细胞密度的机制。一般这类相互作用可以通过一种生命期短的信号分子产生。利用合成生物学的手段,我们可以编辑大肠杆菌的基因,使其恒常分泌并感受环境中的AHL分子。局域的AHL分子浓度与局部的细胞密度正相关,因而可以作为一个群体感应活性粒子系统的模型。如果我们进一步让细胞在高密度区域降低自身的运动活性,我们确实可以看到细胞的聚集。考虑到细胞的繁殖与死亡,我们实际会在系统中看到斑图(C. Liu, et al, Science, 2011)。
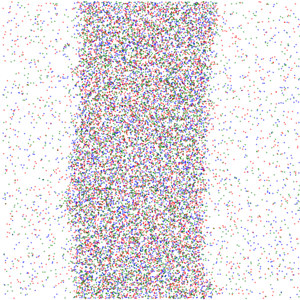
群体感应活性粒子的运动诱导相分离,通过三种活性粒子间的互相抑制运动活性产生
两体力相互作用是指机械力。人们意外地发现即使是纯粹的短程相互排斥力(即碰撞)就已足够使活性粒子聚集,并产生气液相分离。这里的物理图像有些类似二维或三维空间中的交通拥堵。

力相互作用的活性粒子的运动诱导相分离,相互作用势是短程的排斥势
因为活性系统的非平衡态特质,一般平衡态系统的热力学不再对活性液体有效,一般来说无法使用自由能来描述这类系统。如何寻找这类非平衡稳态的广义热力学依然是一个开放的问题。
代表论文
*具有相同贡献的作者
- Agnese I. Curatolo*, Nan Zhou*, Yongfeng Zhao*, Chenli Liu, Adrian Daerr, Julien Tailleur, Jian-Dong Huang, "Cooperative pattern formation in multi-component bacterial systems through reciprocal motility regulation", Nat. Phys. 16, 1152–1157 (2020). Preprint, Nat. Phys.